テキスト
ボイルの法則
- 温度が一定の時、気体の圧力と体積は反比例する
P×V=一定
P1×V1=P2×V2
P:圧力 V:体積
P1×V1=P2×V2
P:圧力 V:体積
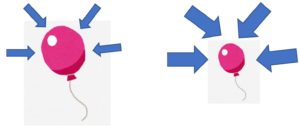
- 温度が一定の場合、風船を気圧(圧力)の高いとこへもっていくと体積が小さくなる
- 圧力が2倍なら体積は1/2倍
シャルルの法則
- 圧力一定の時、体積は絶対温度に比例する
V/T=一定
V1/T1=V2/T2
V:体積 T:絶対温度
V1/T1=V2/T2
V:体積 T:絶対温度

- 圧力一定の場合、風船内の温度が上がれば、体積は大きくなる
- 絶対温度が2倍になると体積も2倍
ボイル―シャルルの法則
- ボイルの法則とシャルルの法則を合わせた法則
- 一定量の気体の体積は、圧力に反比例し、絶対温度に比例する
PV/T=一定
P:圧力 V:体積 T:絶対温度
P:圧力 V:体積 T:絶対温度
理想気体
- 分子間力や体積を無視した仮想的な気体
- 高温、低圧の実在気体は理想気体に近い
理想気体の状態方程式
- 理想気体の量、圧力、体積、絶対温度の関係を表す式
P×V=n×R×T
P:体積 T:絶対温度 n:理想気体の量 R:気体定数
P:体積 T:絶対温度 n:理想気体の量 R:気体定数
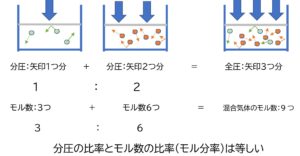
ドルトンの分圧の法則
- 混合気体の全圧は、成分気体の分圧の和に等しい
混合気体の各成分の分圧=全圧×モル分率
臨界現象
- 気体が液体との共存領域を経ずに、直接液体に変わる現象を臨界現象、その点を臨界点という
- 臨界温度以上では、圧力をどんなに上げても気体を液化することはできない
粘性・粘度
- 粘性―液体や気体が流動する際、各成分が互いに抵抗し合う性質
- 粘度―抵抗しあう程度
- 気体の粘度は温度が高くなると大きくなるが、圧力が変わってもほとんど変わらない
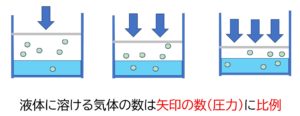
ヘンリーの法則
- 溶解度が小さい気体では、 一定温度で液体に溶解する気体の量は気体の圧力に比例
ラウールの法則
- 溶媒に不揮発性物質を溶解すると、 純溶媒に比べて蒸気圧が低下する
動画コンテンツ
ミニテスト
第1問
第2問
第3問
第4問
過去問題
第1問
理想気体に関する次の記述のうち、誤っているものはどれか
第2問
気体の法則に関する次の記述のうち、誤っているものはどれか
第3問
気体の性質に関する次の記述のうち、誤っているものはどれか
第4問
気体の諸性質に関する次の記述のうち、誤っているものはどれか
計算テキスト
ボイル―シャルルの法則
PV/T=一定
P:圧力 V:体積 T:絶対温度
P:圧力 V:体積 T:絶対温度
気体の状態方程式
P×V=n×R×T
P:体積 T:絶対温度 n:理想気体の量 R:気体定数
P:体積 T:絶対温度 n:理想気体の量 R:気体定数
絶対温度
絶対温度(T)=摂氏温度(℃)+273
- ボイル―シャルルの法則や気体の状態方程式を使う際は絶対温度を用いる
モル(mol)
- 原子や分子のセット数
- 各原子や分子を6×1023個集めると1molになる
モルのイメージ

茶碗に入ったご飯に対し、お米○○粒とは数えませんよね?普通は茶碗1杯とか○○合と数えるはずです。モルも一緒で、原子や分子、6×1023個の集まりを1molと数えます
各単原子物質(ガス主でよく出る)のモル質量
C=12g N=14g O=16g H=1g
各多原子物質(ガス主でよく出る)のモル質量
酸素(O2)=O(16g)×2=32g
窒素(N2)=N(14g)×2=28g
メタン(CH4)=C(12g)+H(1g)×4=16g
プロパン(C3H8)=C(12g)×3+H(1g)×8=44g
水(H2O)=H(1g)×2+O(16g)=18g
窒素(N2)=N(14g)×2=28g
メタン(CH4)=C(12g)+H(1g)×4=16g
プロパン(C3H8)=C(12g)×3+H(1g)×8=44g
水(H2O)=H(1g)×2+O(16g)=18g
過去問題(計算問題)
第1問

第2問

第3問

第4問






